कक्षा 10 विज्ञान अध्याय 4: कार्बन एवं उसके यौगिक – महत्वपूर्ण नोट्स व प्रश्न-उत्तर
कार्बन का सामान्य परिचय
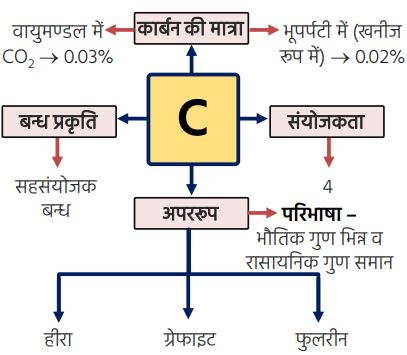
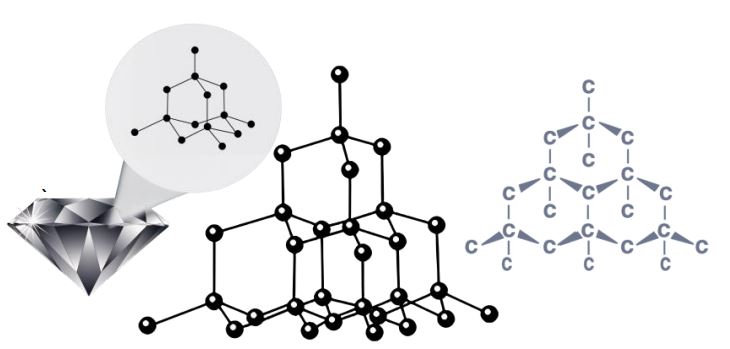
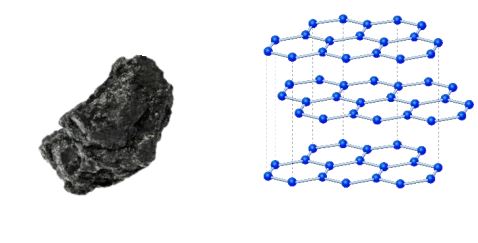
- ➠इसमें प्रत्येक कार्बन परमाणु कार्बन के अन्य चार परमाणुओं से जुड़कर एक कठोर त्रि-विमीय संरचना बनाता है।
- ➠हीरा सर्वाधिक कठोर पदार्थ होता है।
- ➠प्रत्येक कार्बन परमाणु तीन अन्य कार्बन अणुओं से उसी तल में जुड़ा होता है, जिससे षट्कोणीय व्यूह मिलता है।
- ➠इनमें एक आबंध द्विबंध होता है, जिससे कार्बन की संयोजकता पूर्ण हो जाती है।
- ➠यह विद्युत का सुचालक होता है।
- ➠यह चिकना व फिसलनशील होता है।
उदाहरण – पेंसिल की नोंक ग्रेफाइट की बनी होती है।
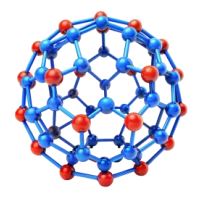
- ➠ सर्वप्रथम C-60 की पहचान की गई।
- ➠ इसमें कार्बन परमाणु फुटबाल के रूप में व्यवस्थित होते हैं।
- ➠ इसका नाम अमेरिकी आर्किटेक्ट व डिज़ाइनर बकमिन्स्टर फुलर के नाम पर रखा गया।
कार्बन में आबंध—
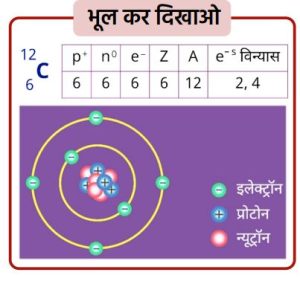
- ➠कार्बन की परमाणु संख्या 6
- ➠कार्बन का इलेक्ट्रॉनिक विन्यास 2, 4
- ➠कार्बन को बाहरी कोश पूर्ण करने के लिए 4 इलेक्ट्रॉन त्यागने या 4 इलेक्ट्रॉन ग्रहण करने होंगे, जिससे उत्कृष्ट गैस विन्यास प्राप्त कर सके।
- ➠4 इलेक्ट्रॉन प्राप्त करने पर C ऋणायन बन सकता है, जिससे प्रोटॉन 6 व इलेक्ट्रॉन 10 हो जाएँगे — यह संभव नहीं हो सकता।
- ➠4 इलेक्ट्रॉन त्यागने पर C⁺ धनायन बन सकता है, जिससे नाभिक में 6 प्रोटोन व 2 इलेक्ट्रॉन रह जाएँ — इस प्रक्रिया में ⇒अत्यधिक ऊर्जा की आवश्यकता होगी।
- ➠अतः कार्बन अपने अन्य परमाणुओं अथवा अन्य तत्वों के परमाणुओं के साथ इलेक्ट्रॉन की साझेदारी कर अणुओं का निर्माण करता है तथा उत्कृष्ट गैस विन्यास प्राप्त करता है।
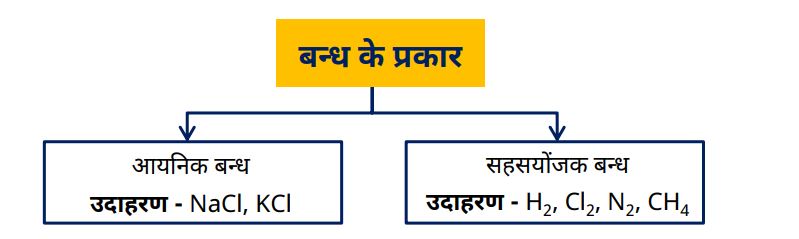
| क्र.स. | आयनिक आबंध | सहसंयोजक आबंध |
|---|
| 1 | आयनिक आबंध, दो असमान (धातु और अधातु) परमाणुओं के बीच इलेक्ट्रॉन स्थानांतरण से बनता है। | सहसंयोजक आबंध में परमाणु इलेक्ट्रॉन साझा करते हैं। |
| 2 | धातु और अधातु के बीच आयनिक आबंध बनता है। | दो अधातुओं के बीच सहसंयोजक आबंध बनता है। |
| 3 | अणुओं का निश्चित आकार नहीं होता क्योंकि इनमें जालक संरचना होती है। | अणुओं का निश्चित आकार होता है। |
| 4 | विद्युत और तापीय चालकता अधिक होती है। | विद्युत चालकता नहीं होती। तापीय चालकता कम होती है। |
| 5 | सामान्यतः उच्च गलनांक होता है। | इनका गलनांक कम होता है। |
| 6 | जल में अत्यधिक घुलनशील होते हैं। | जल में कम घुलनशील होते हैं। |
| 7 | कमरे के तापमान पर ठोस होते हैं। | ठोस, द्रव या गैस रूप में पाए जाते हैं। |
उदाहरण —
1.हाइड्रोजन का अणु
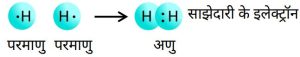
2.ऑक्सीजन अणु
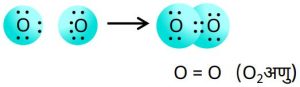
3.नाइट्रोजन अणु
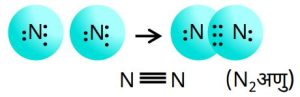
4.मीथेन (CH₄) (संपीड़ित प्राकृतिक गैस)
- ➠यह कार्बन का एक यौगिक है।
- ➠हाइड्रोजन की संयोजकता 1 है।
- ➠कार्बन की संयोजकता 4 है क्योंकि इसमें 4 संयोजी इलेक्ट्रॉन होते हैं।
- ➠उत्कृष्ट गैस विन्यास प्राप्त करने के लिए कार्बन का एक परमाणु हाइड्रोजन के चार परमाणुओं से इलेक्ट्रॉनों का साझा करता है।
नोट :
- ☛ दो परमाणुओं के मध्य एक इलेक्ट्रॉन वाला आबंध सहसंयोजी आबंध कहलाता है।
- ☛ सहसंयोजी यौगिक में अणुक बल कम होता है।
- ☛ सहसंयोजी यौगिकों के गलनांक व क्वथनांक कम होते हैं।
- ☛ सहसंयोजी यौगिक सामान्यतः विद्युत के कुचालक होते हैं।
कार्बन का श्रृंखलन –
- ➠कार्बन में कार्बन के ही अन्य परमाणुओं के साथ आबंध बनाने के गुण को श्रृंखलन कहते हैं।
- ➠श्रृंखलन गुण वाले यौगिक लंबी श्रृंखला या शाखाओं वाली श्रृंखला में व्यवस्थित पाए जाते हैं।
- ➠ये यौगिक संतृप्त और असंतृप्त दोनों प्रकार के हो सकते हैं।
(a)संतृप्त यौगिक
➠ इनमें कार्बन परमाणु एकल आबंध द्वारा जुड़े होते हैं।
उदाहरण — CH4, C2H6 आदि।
(b)असंतृप्त यौगिक
➠इनमें कार्बन परमाणु द्विआबंध या त्रिआबंध द्वारा जुड़े होते हैं।
उदाहरण — C2H2
बहुचयनात्मक प्रश्न
1.निम्न में से सह-संयोजी यौगिक है —
(अ) CH4
(ब) NaCl
(स) CaCO3
(द) Na2O
उत्तर : (अ)
2.निम्न में कौन असंतृप्त हाइड्रोकार्बन है —
(अ) C2H4
(ब) C4H10
(स) CH4
(द) C6H14
उत्तर : (अ)
3.C3H8 अणु में उपस्थित सहसंयोजक आबंधों की संख्या ………… है।
उत्तर : 10
अतिलघुत्तरात्मक प्रश्न
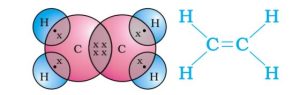
- 1.एथीन अणु की इलेक्ट्रॉन बिंदु संरचना को चित्रित कीजिए। (2023)
- 2.संतृप्त यौगिक व असंतृप्त यौगिक क्या होते है?
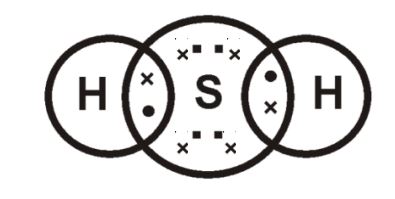
- 3.इलेक्ट्रॉन बिन्दू संरचना बनाइए— [H2S]
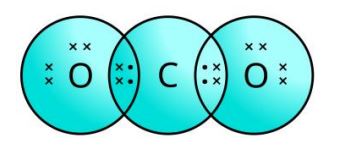
- 4.CO2 सूत्र वाले कार्बन डाइऑक्साइड की इलेक्ट्रॉन बिंदु संरचना क्या होगी?
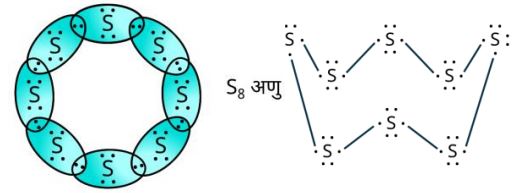
- 5.सल्फ़र के आठ परमाणुओं से बने सल्फ़र के अणु की इलेक्ट्रॉन बिंदु संरचना क्या होगी? (संकेत- सल्फ़र के आठ परमाणु एक अँगूठी के रूप में आपस में जुड़े होते हैं।)
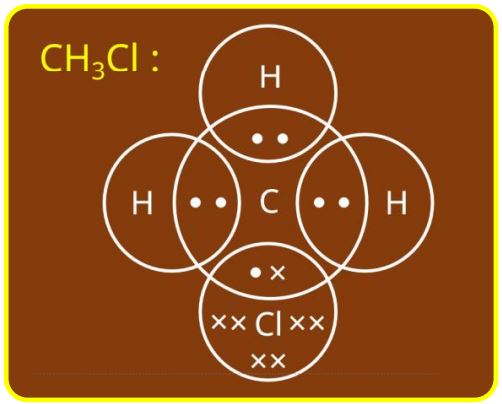
- 6.CH3CI में आबंध निर्माण का उपयोग कर सहसंयोजक आबंध की प्रकृति समझाइए।
अतिलघुत्तरात्मक प्रश्नों के हल
1.
एथीन अणु की इलेक्ट्रॉन बिंदु संरचना —
2.
संतृप्त यौगिक : इनमें कार्बन परमाणु एक आबंध द्वारा जुड़े होते हैं। इनमें कार्बन परमाणु एक आबंध द्वारा जुड़े होते हैं। इनमें कार्बन परमाणु एक आबंध द्वारा जुड़े होते हैं। इनमें कार्बन परमाणु एक आबंध द्वारा जुड़े होते हैं।
उदाहरण : CH, C2H3 आदि।
असंतृप्त यौगिक : इनमें कार्बन परमाणु द्विबंध या त्रिबंध द्वारा जुड़े होते हैं।
उदाहरण : C2H2
3.
इलेक्ट्रॉन बिन्दू संरचना —
4.
CO2 सूत्र वाले कार्बन डाइऑक्साइड की इलेक्ट्रॉन बिंदु संरचना —
5.
सल्फ़र के आठ परमाणुओं से बने सल्फ़र के अणु की इलेक्ट्रॉन बिंदु संरचना —
6.
सहसंयोजक बंध दो परमाणुओं के मध्य इलेक्ट्रॉन के साझे से बनता है।
हाइड्रोकार्बन
➠कार्बन व हाइड्रोजन से बनने वाले सभी कार्बनिक यौगिक हाइड्रोकार्बन कहलाते हैं।
➠संतृप्त हाइड्रोकार्बन ऐल्केन कहलाते है। “ऐल्केन” का सामान्य सूत्र CnH2n+2 होता हैं।
➠असंतृप्त हाइड्रोकार्बन जिसमें एक या अधिक दोहरे बंध (द्विआबंध) होते है “एल्कीन” कहलाते है। एल्कीन का सामान्य सूत्र CnH2n होता हैं।
➠असंतृप्त हाइड्रोकार्बन जिनमें एक या अधिक त्रिआबंध होते है। एल्काइन कहलाते है। “एल्काइन” का सामान्य सूत्र CnH2n – 2 होता है।

- (a) कार्बन तथा हाइड्रोजन के संतृप्त यौगिकों के सूत्र तथा संरचनाएँ —
| कार्बन परमाणु की संख्या | नाम | सूत्र | संरचना |
|---|
| 1 | मीथेन | CH4 | H
|
H - C - H
|
H
|
| 2 | एथेन | C2H6 | H H
| |
H - C - C - H
| |
H H
|
| 3 | प्रोपेन | C3H8 | H H H
| | |
H - C - C - C - H
| | |
H H H
|
| 4 | ब्यूटेन | C4H10 | H H H H
| | | |
H - C - C - C - C - H
| | | |
H H H H
|
| 5 | पेन्टेन | C5H12 | H H H H H
| | | | |
H - C - C - C - C - C - H
| | | | |
H H H H H
|
| 6 | हेक्सेन | C6H14 | H H H H H H
| | | | | |
H - C - C - C - C - C - C - H
| | | | | |
H H H H H H
|
नोट : संरचनात्मक समावयन
- ☛ऐसे यौगिक जिनके आणविक सूत्र समान होते हैं लेकिन संरचना अलग-अलग होती है।
उदाहरण : C4H10
H H H H
| | | |
H — C — C — C — C — H
| | | |
H H H H
- (b) कार्बन तथा हाइड्रोजन के संतृप्त यौगिकों के सूत्र तथा संरचनाएँ —
| कार्बन परमाणु संख्या | नाम | सूत्र | संरचना |
|---|
| 2 | एथीन | C2H4 | 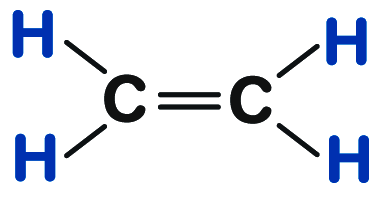 |
| 3 | प्रोपीन | C3H6 | 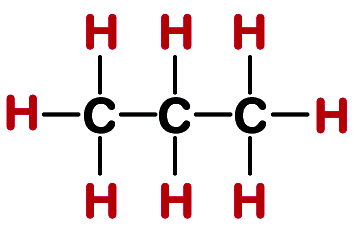 |
| 6 | बेंजीन | C6H6 | 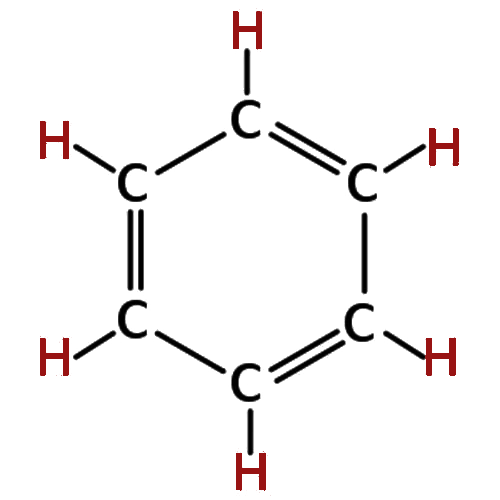 |
नोट:
- ☛हाइड्रोकार्बन श्रृंखला में एक या अधिक हाइड्रोजन को प्रतिस्थापित करने वाले तत्वों को विषम परमाणु कहते हैं।
- ☛ये विषम परमाणु प्रकार्यात्मक समूह में भी उपस्थित होते हैं।
उदाहरण : CH3OH में विषम परमाणु ऑक्सीजन है तथा प्रकार्यात्मक समूह OH है।
H H H H
| | | |
H — C — C — C — C — H
| | | |
H H H H
- (C) कार्बन तथा हाइड्रोजन के संतृप्त यौगिकों के सूत्र तथा संरचनाएँ—
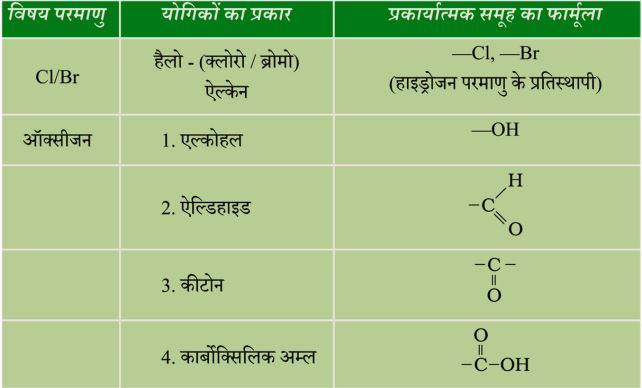
समजातीय श्रेणी—
- ➠ऐसे यौगिक जिनके आणविक सूत्र समान होते हैं लेकिन संरचना अलग-अलग होती है।
उदाहरण : CH3OH, C2H5OH
- ➠समजातीय श्रेणी के भौतिक गुण अलग-अलग होते हैं, किन्तु रासायनिक गुण समान होते हैं।
प्रकारात्मक समूहों की नाम-पद्धति
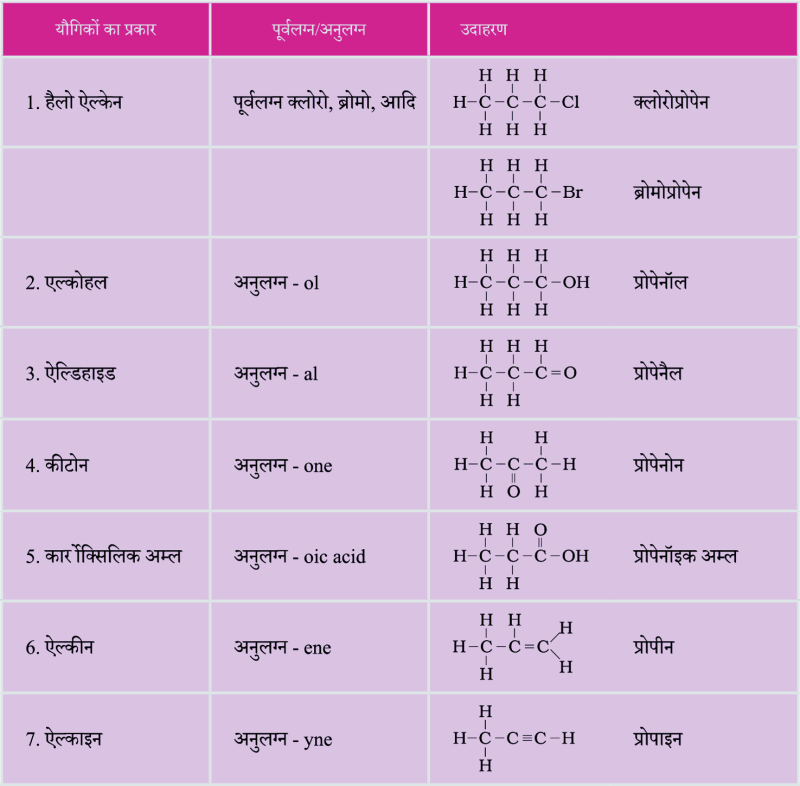
बहुचयनात्मक प्रश्न
1.कीटोन में उपस्थित प्रकार्यात्मक समूह है—
(अ) 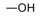
(ब) 
(स) 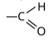
(द) 
उत्तर : (ब)
2.मिथेन, एथेन और प्रोपेन किस श्रेणी के सदस्य है— —
(अ) समजातीय श्रेणी
(ब) बहुलीकरण श्रेणी
(स) अभिजातीय श्रेणी
(द) संघनन श्रेणी
उत्तर : (अ)
3.प्रोपेन का रासायनिक सूत्र है——
(अ) CH4
(ब) C3H8
(स) C4H10
(द) C2H6
उत्तर : (ब)
4.एक अणुसूत्र परंतु विभिन्न संरचना सूत्र वाले यौगिक कहलाते है ——
(अ) बहुलक
(ब) समावयवी
(स) अपररूप
(द) इनमें से कोई नहीं
उत्तर : (ब)
5.ब्यूटेनॉन चर्तु-कार्बन यौगिक है, जिसका प्रकार्यात्मक समूह— —
(अ) कार्बोक्सिलिक अम्ल
(ब) ऐल्डिहाइड
(स) कीटोन
(द) एल्कोहल
उत्तर : (स)
अतिलघुत्तरात्मक प्रश्न
- 2.बेंजीन का अणुसूत्र क्या है?
- 3.एथेनॉइक अम्ल का रासायनिक सूत्र लिखिए।
- 4.असंतृप्त यौगिकों के दो उदाहरण लिखिए।
- 5.प्रोपेनॉन का रासायनिक सूत्र संरचना सहित लिखिए।
- 6.साइक्लोपेन्टेन का सूत्र तथा इलेक्ट्रॉन बिंदु संरचना क्या होंगे?
- 7.निम्नलिखित यौगिकों का नामकरण कैसे करेंगे?
| (i) | CH3—CH2—Br |
| (ii) | H
|
H — C = O |
| (iii) | H H H H
| | | |
H — C — C — C — C ≡ C — H
| | | |
H H H H |
अतिलघुत्तरात्मक प्रश्नों के हल
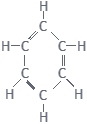
3.
एथेनॉइक अम्ल का रासायनिक सूत्र — CH3COOH
4.
असंतृप्त यौगिकों के दो उदाहरण—
एथाइन (C2H2)
एथीन (C2H4)
5.प्रोपेनॉन का रासायनिक सूत्र (C3H6O)

6.साइक्लोपेन्टेन का सूत्र C5H10 हैं।
साइक्लोपेन्टेन की इलेक्ट्रॉन बिन्दु संरचना है:

- 7.निम्नलिखित यौगिकों का नामकरण—
| (i) | CH3—CH2—Br | ब्रोमोऐथेन |
| (ii) | H
|
H — C = O | मैथेनैल (फार्मेल्डिहाइड) |
| (iii) | H H H H
| | | |
H — C — C — C — C ≡ C — H
| | | |
H H H H | हेक्साइन |
लघुत्तरात्मक प्रश्न
- 1.निम्न के रासायनिक सूत्र लिखिए —
1. प्रोपेनाइक अम्ल
2. ब्रोमोप्रोपेन
लघुत्तरात्मक प्रश्नों के हल
1.
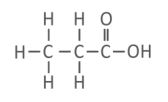
a. प्रोपेनाइक अम्ल – C3H6O2
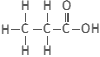
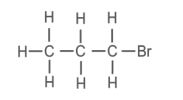
b. ब्रोमोप्रोपेन – (CH3–CH2–CH2—Br)
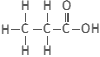
कार्बनिक यौगिकों के रासायनिक गुण —1. दहन :
➠ कार्बन वायु की उपस्थिति में जलकर ऊष्मा व प्रकाश के साथ कार्बन डाइऑक्साइड देता है।
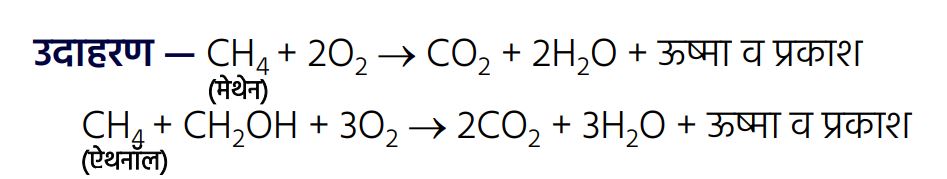
➠ कोयला व पेट्रोलियम ईंधन के दहन पर सल्फर व नाइट्रोजन के ऑक्साइड का निर्माण होता है, जो पर्यावरण प्रदूषक हैं।
➠ संतृप्त हाइड्रोकार्बन जलने पर स्वच्छ ज्वाला देता है, जबकि असंतृप्त हाइड्रोकार्बन कालिख वाली पीली ज्वाला देता है।
2. ऑक्सीकरण :
➠ वह अभिक्रिया जिसमें कार्बनिक यौगिक ऑक्सीकारक तत्व की उपस्थिति में ऑक्सीजन लेते हैं और दूसरे कार्बनिक यौगिक का निर्माण करते हैं।
ऑक्सीकारक — कुछ पदार्थों में अन्य पदार्थों को ऑक्सीजन देने की क्षमता होती है, उन्हें ऑक्सीकारक कहते हैं।
उदाहरण —

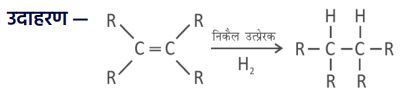
3. संयोजन (संकलन) अभिक्रिया :
➠ असंतृप्त यौगिकों को संतृप्त यौगिक बनाने के लिए परमाणु या परमाणुओं के समूह को असंतृप्त यौगिकों में जोड़ा जाता है। इसे संकलन या संयोजन अभिक्रिया कहते हैं।
➠ यह अभिक्रिया उत्प्रेरकों की सहायता से की जाती है।
➠ कुछ उत्प्रेरक — पैलेडियम तथा निकल
➠ निकल उत्प्रेरक का उपयोग वानस्पतिक तेलों के हाइड्रोजनीकरण में किया जाता है।
➠ भोजन पकाने के लिए असंतृप्त वसायुक्त तेलों का उपयोग करना चाहिए।
4. प्रतिस्थापन अभिक्रिया :
➠ संतृप्त यौगिकों में उपस्थित परमाणु या परमाणुओं के समूह को जब कोई अन्य परमाणु या समूह प्रतिस्थापित करता है, तो उसे प्रतिस्थापन अभिक्रिया कहते हैं।
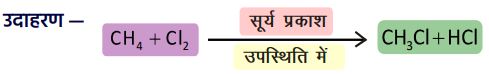
➠ यहाँ क्लोरीन एक विविध परमाणु है जो कार्बन श्रृंखला में से हाइड्रोजन को प्रतिस्थापित करता है।
बहुचयनात्मक प्रश्न1. विस्पति धातुओं के हाइड्रोजन निष्कर्षण में प्रयोग किया जाता है-
(अ) निकल
(ब) लोहा
(स) क्षारीय पोटैशियम
(द) अल्य
उत्तर : (अ)
2. 
उत्तर : (द)
3. संकलित अभिक्रिया निम्न उत्प्रेरक की उपस्थिति में होती है —
(अ) Ni व Pd
(ब) Zn व Mg
(स) Na
(द) उपरोक्त में से कोई नहीं
उत्तर : (अ)
4. असंयुक्त हाइड्रोकार्बन अत्यधिक …………. ज्वाला के साथ जलते हैं।
(अ) पीला
(ब) श्वेत
(स) नीली
(द) हरी
उत्तर : (अ)
लघुत्तरात्मक प्रश्न1. दो ऑक्सीकारक के उदाहरण उनके रासायनिक सूत्र सहित लिखिए।2. एस्टरीकरण अभिक्रिया लिखिए।3. निम्न के रासायनिक सूत्र लिखिए —
a. प्रोपेनाइक अम्ल
b. ब्रोमोप्रोपेन
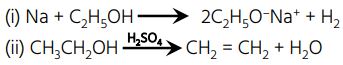
4. निम्नलिखित अभिकर्मकों के साथ एथेनॉल की रासायनिक अभिक्रियाओं के संतुलित समीकरण लिखिए – (2023)
(i) Na
(ii) 443K तापमान पर सांद्र H₂SO₄
5. ऐथेनॉल से एथेनॉइक अम्ल में परिवर्तन को ऑक्सीकरण अभिक्रिया क्यों कहते हैं?6. ऑक्सीजन तथा एथाइन के मिश्रण का दहन वेल्डिंग के लिए किया जाता है। क्या आप बता सकते हैं कि एथाइन तथा वायु के मिश्रण का उपयोग क्यों नहीं किया जाता?लघुत्तरात्मक प्रश्न के हल1. a. ऑक्सीकारक: पोटैशियम पर्मैंगनेट (KMnO₄)
b. ऑक्सीकारक: अम्लीय पोटैशियम क्रोमेट (K₂Cr₂O₇)
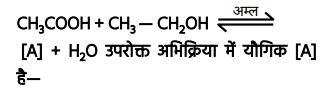
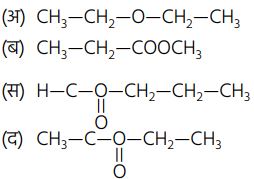
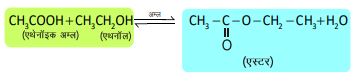
2. एस्टरीकरण अभिक्रिया —
3. a. प्रोपेनाइक अम्ल – C₂H₆O₂
b. ब्रोमोप्रोपेन – CH₃–CH₂–CH₂–Br
4.  5.
5. 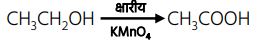
चूंकि इस प्रतिक्रिया में ऐथेनॉल में एक ऑक्सीजन जुड़ती है, इसलिए इसे ऑक्सीकरण अभिक्रिया कहा जाता है।
6. ⚈ एथाइन का मिश्रण ऑक्सीजन के साथ जलाने पर यह अत्यधिक ताप पर नीली ज्वाला के साथ जलती है, जो वेल्डिंग के लिए उपयुक्त है और यह पूर्ण दहन की स्थिति होती है।
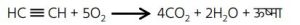
⚈ जबकि एथाइन का मिश्रण हवा के साथ जलाने पर यह काली ज्वाला के साथ जलती है और यह अपूर्ण दहन की स्थिति होती है।
1. एथेनॉल (CH₃CH₂OH) —
➠ एथेनॉल को ऐल्कोहॉल कहा जाता है।
➠ यह कम ताप पर द्रव अवस्था में पाया जाता है।
➠ यह अच्छा त्वरक है।
एथेनॉल का उपयोग —
ऐल्कोहॉल पेय पदार्थों में।
नशे में आयोडीन, कफ सिरप, औषधियों में।
औद्योगिक टेम्पलेट स्प्रिट बनाने में।
इससे लैब में CO₂ और जल निकलता है और ईंधन के रूप में उपयोग।
अभिक्रियाएँ —
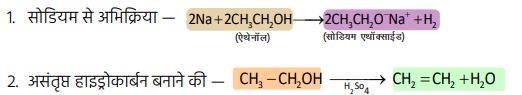
विकृत एल्कोहॉल —
➠ एथेनॉल में जब मेथेनॉल (CH₃OH) जैसा जहरीला पदार्थ मिलाया जाए और इसमें रंजक मिलाकर इसका रंग नीला बना दिया जाए, तब इसे विकृत ऐल्कोहॉल कहा जाता है।
2. एथेनॉइक अम्ल (CH₃COOH)
➠ इसे सामान्यतः ऐसिटिक अम्ल कहा जाता है।
➠ यह कार्बोक्सिलिक अम्ल समूह से संबंधित है।
➠ इसके 3.5 प्रतिशत विलयन को सिरका कहा जाता है, जिसका उपयोग आचार संरक्षण में किया जाता है।
➠ शुद्ध एथेनॉइक अम्ल का गलनांक 290K होता है, इसलिए शीत ऋतु में जमने के कारण इसे ग्लेशियल ऐसिटिक अम्ल कहा जाता है।
➠ इसकी प्रकृति अम्लीय होती है।
➠ यह गंधहीन पदार्थ होता है।
अभिक्रियाएँ —1. एस्टरीकरण अभिक्रिया —
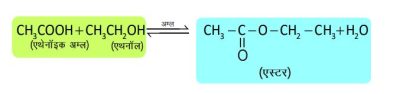
2. साबुनीकरण —
➠ क्षार की उपस्थिति में एस्टर पुनः ऐल्कोहॉल व कार्बोक्सिलिक अम्ल का सोडियम लवण बनाता है जिसे साबुनीकरण कहते हैं।
➠ एस्टर का उपयोग साबुन बनाने के लिए किया जाता है।
➠ साबुन दीर्घ श्रृंखला वाले कार्बोक्सिलिक अम्लों के सोडियम तथा पोटैशियम लवण होते हैं।
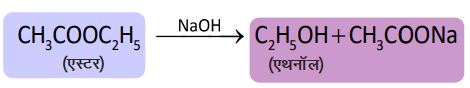
3. क्षारक के साबु अभिक्रिया
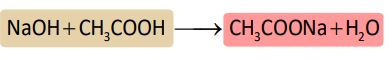
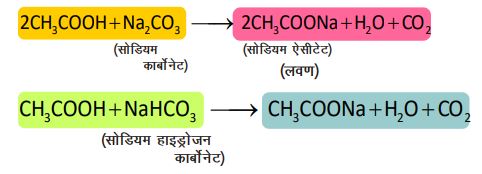
4. कार्बोनेट एवं हाइड्रोजन कार्बोनेट के साबु अभिक्रिया —
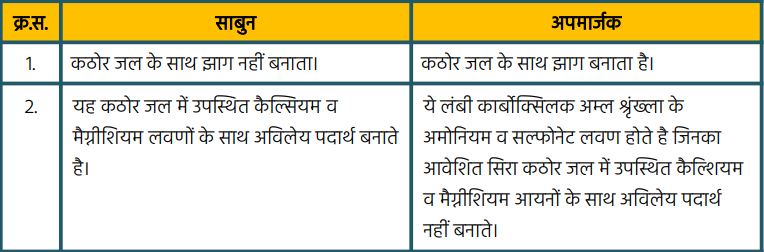
साबुन और अपमार्जकसाबुन –
➠ साबुन के अणु लंबी श्रृंखला वाले कार्बोक्सिलिक अम्लों के सोडियम एवं पोटेशियम लवण होते हैं।
➠ साबुन का आयनिक भाग जल में घुल जाता है, जबकि कार्बन श्रृंखला तेल में घुल जाती है।
➠ साबुन अपनी सफाई प्रक्रिया मिसेल की संरचना बना कर करता है।
1. जलरागी सिरा –
➠ साबुन के अणु के दो सिरों में से वह सिरा जो जल में घुलनशील होता है, उसे जलरागी कहते हैं।
➠ यह आयनिक सिरा होता है।
2. जलविरागी सिरा –
➠ साबुन के अणु का वह सिरा जो हाइड्रोकार्बन में अर्थात् तैलीय मैल में विलयन होता है, उसे जलविरागी सिरा कहते हैं।
➠ मिसेल संरचना में यह अंदर की तरफ होता है।
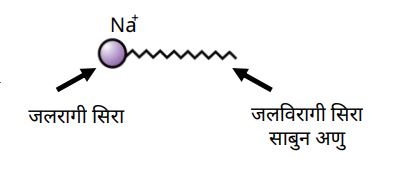
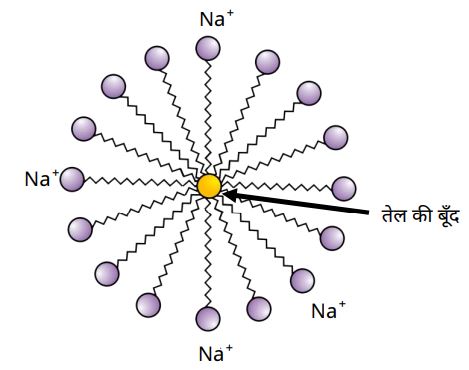
➠ मिसेल के रूप में साबुन स्वच्छ करने में सक्षम होता है क्योंकि तैलीय मैल मिसेल के केन्द्र में एकत्र हो जाते हैं।
➠ मिसेल विलयन में कोलॉइड के रूप में बने रहते हैं तथा आयन-आयन विकर्षण के कारण वे अवक्षेपित नहीं होते।
➠ इस प्रकार मिसेल में तैरते मैल आसानी से हटाए जा सकते हैं।
➠ साबुन के मिसेल प्रकाश को प्रकीर्णित करते हैं, जिसके कारण साबुन का घोल बादल जैसा दिखाई देता है।
बहुचयनात्मक प्रश्न —1. साबुन के अणु के सिरे होते हैं –
(अ) 1
(ब) 2
(स) 3
(द) 4
उत्तर : (अ)
2. Na की एथेनॉल के साथ अभिक्रिया पर गैस प्राप्त होती है –
(अ) N₂
(ब) H₂
(स) O₂
(द) He
उत्तर : (अ)
लघुत्तरात्मक प्रश्न1. ऑक्सीकारक क्या हैं?2. एथेनॉल के चार उपयोग लिखिए।3. साबुन व अपमार्जक में अंतर लिखिए। (कोई दो)4. मिसेल की निर्माण प्रक्रिया समझाइये।लघुत्तरात्मक प्रश्न के हल1. ऑक्सीकारक — ऑक्सीकारक वे पदार्थ होते हैं, जो किसी अन्य पदार्थ को ऑक्सीजन देते हैं या किसी पदार्थ से हाइड्रोजन निकालते हैं।
उदाहरण: अम्लीय K₂Cr₂O₇ या क्षारीय KMnO₄ एक ऑक्सीकारक पदार्थ है, जो एथेनॉल को एथेनॉइक अम्ल में परिवर्तित (ऑक्सीकृत) करता है।
2. एथेनॉल का उपयोग
⚈ ऐल्कोहॉल पेय पदार्थ में
⚈ टिंचर आयोडीन, कफ सीरप, औषधियों में
⚈ औद्योगिक मिथाइलेटेड स्प्रिट बनाने में
⚈ इसे जलाने पर CO₂ व जल निकलता है, अतः ईंधन के रूप में उपयोग।
3.  4. मिसेल निर्माण प्रक्रिया
4. मिसेल निर्माण प्रक्रिया
उदाहरण: C₁₇H₃₅COOK और C₁₇H₃₅COONa
⚈ साबुन के अणु लंबी श्रृंखला वाले कार्बोक्सिलिक अम्लों के सोडियम व पोटैशियम लवण होते हैं।
⚈ साबुन के दो सिरों में से एक सिरा जल में विलेय होता है जिसे जलरागी सिरा कहते हैं। यह आयनिक सिरा होता है।
⚈ साबुन का दूसरा सिरा हाइड्रोकार्बन, अर्थात् तैलीय मैल में विलेय, होता है जिसे जलविरागी सिरा कहते हैं।
⚈ जब साबुन जल की सतह पर होता है, तब इसके अणु अपने आप इस प्रकार व्यवस्थित हो जाते हैं कि:
⚈ आयनिक सिरा जल के अंदर होता है।
⚈ हाइड्रोकार्बन पूँछ जल के बाहर होती है।
⚈ जल के अंदर इन अणुओं की एक विशेष व्यवस्था होती है, जिसमें जलविरागी पूँछ गुच्छे के आंतरिक हिस्से में होती है, जबकि आयनिक सिरा गुच्छे की सतह पर होता है।
⚈ इस संरचना को मिसेल कहते हैं।
























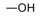





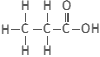
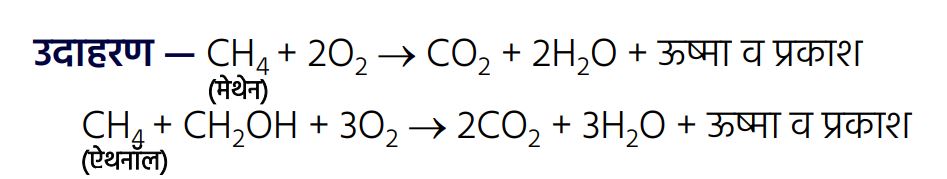









 5.
5. 

















