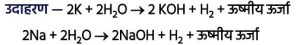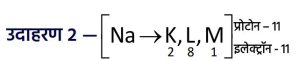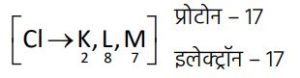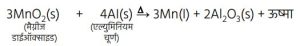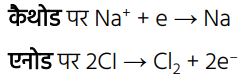कक्षा 10 विज्ञान – अध्याय 3: धातु एवं अधातु
धातु के भौतिक गुण: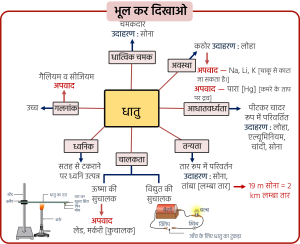 अधातु के भौतिक गुण:
अधातु के भौतिक गुण: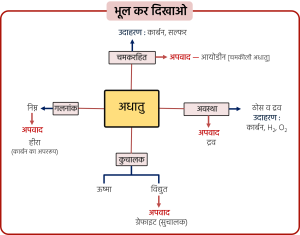 बहुविकल्पीय प्रश्न / रिक्त स्थान
बहुविकल्पीय प्रश्न / रिक्त स्थान
- निम्न में से धातु का गुण नहीं है –
(अ) ध्वनिक
(ब) तन्यता
(स) आघातवर्ध्यता
(द) चमकरहित
उत्तर – (द) - ऊष्मा का सबसे अच्छा चालक है – (2024)
(अ) कॉपर
(ब) लेड
(स) मर्करी
(द) जिंक
उत्तर – (अ) - Al, Fe तथा Zn की अभिक्रियाशीलता का सही बढ़ता क्रम है – (2023)
(अ) Fe < Zn < Al
(ब) Fe < Al < Zn
(स) Al < Fe < Zn
(द) Al < Zn < Fe
उत्तर – (अ) - ग्रेफाइट होता है –
(अ) विद्युत का कुचालक
(ब) विद्युत का सुचालक
(स) दोनों कुचालक व सुचालक
(द) इनमें से कोई नहीं
उत्तर – (ब) - इनमें से कौन अधातु होते हुए भी चमकीला होता है –
(अ) कार्बन
(ब) ब्रोमीन
(स) आयोडीन
(द) इनमें से कोई नहीं
उत्तर – (स) - सर्वाधिक आघातवर्ध्य धातु कौन-सी है –
(अ) चाँदी
(ब) टीन
(स) पीतल
(द) सोना
उत्तर – (द)
अतिलघुत्तरात्मक प्रश्न:
- पीतल में ताँबा के साथ मिश्रित दूसरी धातु का नाम लिखिए। (2024)
- सल्फर, ब्रोमीन तथा आयोडीन में से चयन करके द्रव अधातु का नाम लिखिए। (2024)
- प्रकृति में सबसे कठोर पदार्थ कौनसा होता है?
- किन्ही चार अधातु के नाम लिखिये।
अतिलघुत्तरात्मक प्रश्न के हल:
- पीतल = ताँबा + जस्ता
- ब्रोमीन (Br)
- सबसे कठोर पदार्थ हीरा होता है जो कि कार्बन का एक अपररूप है।
- चार अधातु –
- कार्बन
- सल्फर
- ऑक्सीजन
- हाइड्रोजन
लघुत्तरात्मक प्रश्न:
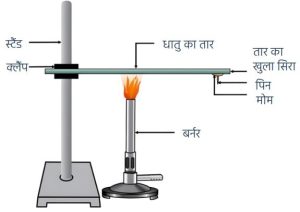
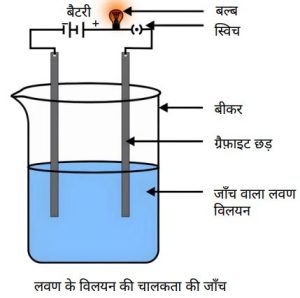
- “धातुएँ विद्युत की सुचालक होती हैं।”
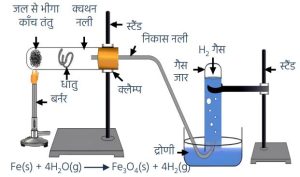
उपरोक्त कथन के प्रयोगशाला परीक्षण के लिए प्रयुक्त व्यवस्थित उपकरण को चित्रित कीजिए। (2024) - लोह धातु पर भाप की क्रिया का नामांकित चित्र बनाइये।
- धातु एवं अधातु में अन्तर लिखिए।
लघुत्तरात्मक प्रश्न के हल
2.
3. धातु एवं अधातु में अंतर—
| क्रमांक | धातु | अधातु |
|---|---|---|
| 1. | चमकदार होते हैं। जैसे– सोना, चाँदी | चमकदार नहीं होते हैं। जैसे– कार्बन, सल्फर अपवाद – आयोडीन |
| 2. | कठोर होते हैं तथा ठोस अवस्था में पाए जाते हैं। जैसे– लोहा अपवाद – लीथियम, सोडियम, पोटैशियम अपवाद – मर्करी (Hg) द्रव अवस्था में) | ठोस अथवा गैस अवस्था में पाए जाते हैं। जैसे– हाइड्रोजन, ऑक्सीजन अपवाद – ब्रोमीन (द्रव अवस्था में) |
| 3. | आघातवर्ध्य होते हैं। जैसे– लोहा, एल्यूमीनियम | आघातवर्ध्य नहीं होते हैं। |
| 4. | तन्य होते हैं। जैसे– सोना | तन्य नहीं होते हैं। |
| 5. | ऊष्मा के सुचालक होते हैं। जैसे– ऐल्युमिनियम, कॉपर अपवाद – लेड, मर्करी (कुचालक) | ऊष्मा के कुचालक होते हैं। |
| 6. | विद्युत के सुचालक होते हैं। जैसे– सिल्वर, कॉपर अपवाद – ग्रेफाइट (सुचालक अधातु) | विद्युत के कुचालक होते हैं। |
| 7. | गलनांक बहुत अधिक होता है। अपवाद – गैलियम, सीज़ियम | गलनांक बहुत कम होता है। |
| 8. | ध्वनिक होती हैं। | ध्वनिक नहीं होती हैं। |
धातुओं के रासायनिक गुण:
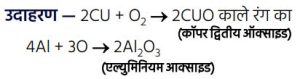
1. धातुओं का वायु में दहन –
धातु वायु में उपस्थित ऑक्सीजन के साथ क्रिया कर धातु ऑक्साइड बनाते हैं।
समीकरण:
धातु + ऑक्सीजन → धातु ऑक्साइड (क्षारीय प्रकृति के)\
उभयधर्मी ऑक्साइड –
कुछ धातु ऑक्साइड अम्लीय तथा क्षारीय दोनों प्रकृति के होते हैं।
ये अम्ल तथा क्षारक दोनों से अभिक्रिया कर लवण व जल बनाते हैं।
धातु ऑक्साइड सामान्यतः जल में अघुलनशील होते हैं।
अपवाद – सोडियम ऑक्साइड (Na₂O) और पोटैशियम ऑक्साइड (K₂O) जल में घुलकर क्षार बनाते हैं।
धातु + ऑक्सीजन → धातु ऑक्साइड (क्षारीय प्रकृति के)
याद रखें — पोटैशियम तथा सोडियम धातुओं को केरोसिन तेल में डुबाकर रखा जाता है क्योंकि ये धातुएँ अत्यधिक सक्रिय होने के कारण खुले में आग पकड़ लेती है।
सिल्वर व गोल्ड अधिक ताप पर भी ऑक्सीजन के साथ अभिक्रिया नहीं करते हैं।
याद रखें — ऐनोडीकरण — वायु के संपर्क में आने पर ऐल्युमिनियम पर ऑक्साइड की पतली परत का निर्माण होता है, यह परत एल्युमिनियम को संक्षारण से बचाती है।
इस प्रक्रिया को और मोटा करने की प्रक्रिया एनोडिकरण कहलाती है।
प्रक्रिया : एल्युमिनियम धातु को ऐनोड बनाकर तनु सल्फ्युरिक अम्ल के साथ इसका विद्युत-अपद्यटन किया जाता है। ऐनोड पर उत्सर्जित ऑक्सीजन गैस एल्युमिनियम के साथ अभिक्रिया कर ऑक्साइड की मोटी परत बनाती है।
2. धातुओं की जल के साथ अभिक्रिया—
धातु + जल → धातु ऑक्साइड + हाइड्रोजन गैस
- जो धातु ऑक्साइड जल में घुलनशील है, वह धातु हाइड्रॉक्साइड देती है।
किन्तु सभी धातुएँ जल के साथ अभिक्रिया नहीं करती हैं।
धातु ऑक्साइड + जल → धातु हाइड्रॉक्साइड
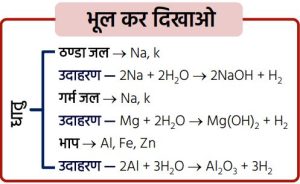
पोटैशियम व सोडियम अत्यधिक सक्रिय होने के कारण ठण्डे जल से तीव्रता से अभिक्रिया कर ऊष्मा उत्पन्न करते हैं। अतः ये अभिक्रियाएँ ऊष्माक्षेपी होती हैं।
कैल्सियम व मैग्नीशियम जल से अभिक्रिया तो करते हैं, परन्तु धीरे-धीरे।
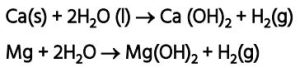
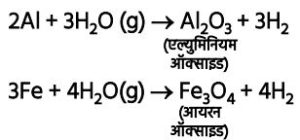
➢ एल्युमिनियम, आयरन, जिंक आदि केवल गरम जल से अभिक्रिया करते हैं और तब भाप से क्रिया कर धातु ऑक्साइड व हाइड्रोजन प्रदान करते हैं।
नोट — लेड (Pb), कॉपर (Cu), सिल्वर (Ag), गोल्ड (Au) धातुएँ जल से बिल्कुल अभिक्रिया नहीं करती हैं।
3. धातुओं की अम्लों के साथ अभिक्रिया—
धातु + अम्ल → लवण + हाइड्रोजन गैस
Mg + 2HCl → MgCl₂ + H₂
Zn + H₂SO₄ → ZnSO₄ + H₂
प्रश्न : धातुएँ नाइट्रिक अम्ल (HNO₃) के साथ क्रिया कर हाइड्रोजन गैस उत्सर्जित क्यों नहीं करती हैं?
उत्तर : क्योंकि HNO₃ एक प्रबल ऑक्सीकारक है, जो H₂ को ऑक्सीकरण कर H₂O बना देता है।
साथ ही, स्वयं नाइट्रिक अम्ल के ऑक्साइड जैसे — N₂O, NO, NO₂ में अपचयित हो जाता है।
अपवाद — मैग्नीशियम (Mg) व मैंगनीज़ (Mn) अत्यंत तनु (dilute) HNO₃ के साथ अभिक्रिया कर हाइड्रोजन गैस उत्सर्जित करते हैं।
नोट — ऐक्वा रेजिया (Aqua Regia) :
- यह सांद्र हाइड्रोक्लोरिक अम्ल (HCI) व सांद्र नाइट्रिक अम्ल (HNO3) का अनुपात 3 : 1 का मिश्रण होता है।
- यह द्रव अवस्था में होता है तथा प्रबल संक्षारक होता है।
- यह गोल्ड (Au) व प्लेटिनियम (Pt) धातु को गला सकता है।
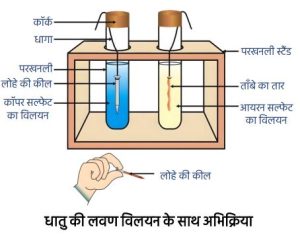
धातु की लवणों के विलयन के साथ अभिक्रिया—
अभिक्रियाशील धातु अपने से कम अभिक्रियाशील धातु को उसके यौगिक के विलयन या गलन अवस्था से विस्थापित कर देती है।
उदाहरण —
धातु (A) + (B) का लवण विलयन → धातु (A) का लवण विलयन + धातु (B)
यहाँ धातु (A) ने धातु (B) को उसके विलयन से विस्थापित किया।
अतः धातु (A) अधिक क्रियाशील है धातु (B) की तुलना में।
Fe + CuSO₄ → FeSO₄ + Cu
अतः Fe अधिक क्रियाशील है Cu से।
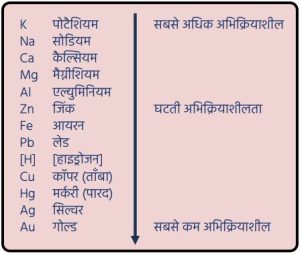
धातुओं का क्रियाशीलता क्रम:
धातु व अधातु की अभिक्रिया —
- कोई भी तत्व अपने संयोजकता कोश को पूर्ण करने के लिए दूसरे तत्व से अभिक्रिया करता है।
- उत्कृष्ट (निष्क्रिय) गैसों का संयोजकता कोश पहले से ही पूर्ण होता है, इसलिए उनकी अभिक्रियाशीलता बहुत कम होती है।
उदाहरण 1 —
आर्गन (Ar) का इलेक्ट्रॉनिक विन्यास 2, 8, 8 होता है। इसका संयोजकता कोश (M) 8 इलेक्ट्रॉनों से पूर्ण होने के कारण यह गैस बहुत कम अभिक्रियाशील होती है।
(K) (L) (M)
2 8 8
- सोडियम (Na) परमाणु के बाह्यतम कोश में एक इलेक्ट्रॉन होता है।
अतः यह अपना एक इलेक्ट्रॉन त्यागकर कोश L को बाह्यतम बना लेता है, जो कि पूर्ण होता है।
इसके परिणामस्वरूप 11 प्रोटॉन लेकिन केवल 10 इलेक्ट्रॉन होने के कारण यह धनावेशित हो जाता है,
और सोडियम धनायन (Na⁺) बन जाता है।
इसी प्रकार क्लोरीन (Cl) के बाह्यतम कोश में 7 इलेक्ट्रॉन होते हैं।
अष्टक पूर्ण करने के लिए इसे 1 इलेक्ट्रॉन की आवश्यकता होती है।
अतः यह सोडियम द्वारा त्यागा गया 1 इलेक्ट्रॉन ग्रहण कर लेता है और कुल 18 इलेक्ट्रॉन प्राप्त कर लेता है।
परिणामस्वरूप, इसमें 17 प्रोटॉन और 18 इलेक्ट्रॉन होने के कारण क्लोराइड आयन (Cl⁻) बनता है।
इस प्रकार परस्पर इलेक्ट्रॉन के आदान-प्रदान से सोडियम और क्लोरीन के बीच संबंध स्थापित हो जाता है।
आयनिक यौगिकों के गुणधर्म:
भौतिक प्रकृति — धन और ऋण आयनों के मध्य आकर्षण बल होने के कारण ये ठोस और कठोर होते हैं। ये भंगुर प्रकृति के भी होते हैं, यानी दबाव पड़ने पर टूट जाते हैं।
गलनांक व क्वथनांक — इनके आयनिक आकर्षण बल को तोड़ने के लिए अधिक ऊष्मा की आवश्यकता होती है, अतः इनके गलनांक और क्वथनांक उच्च होते हैं।
घुलनशीलता — ये जल में घुलनशील तथा नॉन-पोलर विलायकों जैसे – पेट्रोल, केरोसिन आदि में अविलेय होते हैं।
विद्युत चालकता — विद्युत के संचालन के लिए आयनों की गतिशीलता आवश्यक होती है।
विलयन में विद्युत धारा प्रवाहित करने पर आयन विपरीत इलेक्ट्रोड की ओर गमन करते हैं।
नोट — ठोस अवस्था में आयनों की गति संभव नहीं होने के कारण आयनिक यौगिक ठोस अवस्था में विद्युत का संचालन नहीं करते।
बहुचयनात्मक प्रश्न—
सबसे अधिक सक्रिय धातु है –
(अ) पोटैशियम
(ब) सोडियम
(स) लोहा
(द) ताँबा
(अ)निम्न में से कौन आयनिक यौगिक है –
(अ) CHA
(ब) CO₂
(स) CaCl₂
(द) H₂
(स)लोहा ऑक्सीजन से संयोग कर क्या बनता है –
(अ) FeS
(ब) FeSO₄
(स) Fe₂O₃
(द) FeCO₃
(स)धातु के ऑक्साइड होते है –
(अ) अम्ल
(ब) क्षारक
(स) लवण
(द) इनमें से कोई नहीं
(ब)
लघुत्तरात्मक प्रश्न—
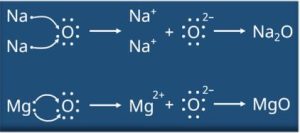
- सोडियम, ऑक्सीजन एवं मैग्नीशियम के लिए इलेक्ट्रॉन-बिंदु संरचना लिखिए।
- इलेक्ट्रॉन के स्थानांतरण के द्वारा Na₂O एवं MgO का निर्माण दर्शाइए।
- Na₂O एवं MgO यौगिकों में कौन से आयन उपस्थित हैं?
- आयनिक यौगिकों का गलनांक उच्च क्यों होता है?
- उभयधर्मी ऑक्साइड क्या होते हैं? दो उभयधर्मी ऑक्साइडों का उदाहरण दीजिए।
- दो धातुओं के नाम बताइए जो तनु अम्ल से हाइड्रोजन को विस्थापित कर देंगे तथा दो धातुएँ जो ऐसा नहीं कर सकती हैं।
- ऑक्सीजन के साथ संयुक्त होकर अधातुएँ कैसा ऑक्साइड बनाती हैं?
- रासायनिक गुणधर्मों के आधार पर धातुओं एवं अधातुओं में विभेद कीजिए।
- उभयधर्मी धातु ऑक्साइड के दो उदाहरण लिखिए।
- सबसे कम 4 क्रियाशील धातुओं का नाम लिखिए।
- ऐक्वा रेजिया क्या होता है?
- धातुओं की जल के साथ अभिक्रिया का एक उदाहरण अभिक्रिया सहित समझाइए।
- आयनिक यौगिकों के कोई चार गुणधर्म लिखिए।
लघुत्तरात्मक प्रश्न के हल —
- सोडियम के लिए इलेक्ट्रॉन-बिंदु संरचना —
सोडियम परमाणु (2, 8, 1) = Na
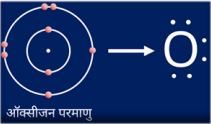
ऑक्सीजन के लिए इलेक्ट्रॉन-बिंदु संरचना —
ऑक्सीजन परमाणु (2, 6) = O
मैग्नीशियम के लिए इलेक्ट्रॉन-बिंदु संरचना —
मैग्नीशियम परमाणु (2, 8, 2) = Mg2.
- इन यौगिकों में Mg²⁺, O²⁻ एवं Na⁺ आयन उपस्थित हैं।
- आयनिक यौगिकों में परस्पर आयनिक आकर्षण बल बहुत अधिक शक्तिशाली होता है।
अतः इस बंध को तोड़ने के लिए अत्यधिक ऊर्जा की आवश्यकता होती है,
इसलिए इनका गलनांक उच्च होता है। - वे धातु ऑक्साइड जो अम्ल और क्षारक दोनों से अभिक्रिया करके लवण तथा जल प्रदान करते हैं, उभयधर्मी ऑक्साइड कहलाते हैं।
जैसे – एल्युमिनियम ऑक्साइड (Al₂O₃), जिंक ऑक्साइड (ZnO)
अभिक्रिया:
Al₂O₃ + 2NaOH → 2NaAlO₂ + H₂O
Al₂O₃ + 6HCl → 2AlCl₃ + 3H₂O6. हाइड्रोजन की तुलना में अधिक क्रियाशील धातुएँ इसे तनु अम्ल से विस्थापित कर देती हैं।
जैसे – Mg, Zn
हाइड्रोजन की तुलना में कम क्रियाशील धातुएँ इसे तनु अम्ल से विस्थापित नहीं कर सकती हैं।
जैसे – तांबा (Cu), चाँदी (Ag)7. अधातुएँ ऑक्सीजन के साथ संयुक्त होकर अम्लीय ऑक्साइड बनाती हैं।
जैसे – S(s) + O₂(g) → SO₂(g)8.
धातु
अधातु
1.
क्षारीय प्रकृति के ऑक्साइड बनाते हैं। अम्लीय या उदासीन प्रकृति के बनाते हैं। 2.
धातु ऑक्साइड जल से अभिक्रिया करके क्षार बनाते हैं। अधातु के ऑक्साइड जल से अभिक्रिया करके अम्ल बनाते हैं। 3.
यह तनु अम्लों से हाइड्रोजन विस्थापित करते हैं। यह तनु अम्लों से हाइड्रोजन विस्थापित नहीं करते हैं। 4.
ये विद्युत धनात्मक तत्व है। ये विद्युत ऋणात्मक तत्व ह 9. उभयधर्मी धातु ऑक्साइड के उदाहरण –
- एल्युमिनियम ऑक्साइड (Al₂O₃)
- जिंक ऑक्साइड (ZnO)10. सबसे कम चार क्रियाशील धातुएँ —
- कॉपर (Cu)
- मर्करी (पारा) (Hg)
- सिल्वर (चाँदी) (Ag)
- गोल्ड (सोना) (Au)
11. ऐक्वा रेजिया (Aqua Regia) —
यह सांद्र हाइड्रोक्लोरिक अम्ल (HCl) व सांद्र नाइट्रिक अम्ल (HNO₃) का 3 : 1 के अनुपात में मिश्रण होता है।
यह द्रव अवस्था में होता है तथा प्रबल संक्षारक होता है।
यह गोल्ड (Au) व प्लेटिनम (Pt) धातुओं को घोल सकता है।12. धातुओं की जल के साथ अभिक्रिया —
धातु + जल → धातु ऑक्साइड + हाइड्रोजन गैसजो धातु ऑक्साइड जल में घुलनशील होते हैं, वे धातु हाइड्रॉक्साइड बनाते हैं।
किन्तु सभी धातुएँ जल के साथ अभिक्रिया नहीं करती हैं।उदाहरण —
2K + 2H₂O → 2KOH + H₂ + ऊष्मीय ऊर्जा
2Na + 2H₂O → 2NaOH + H₂ + ऊष्मीय ऊर्जापोटैशियम व सोडियम अत्यधिक सक्रिय होने के कारण ठण्डे जल से तेजी से अभिक्रिया कर ऊर्जा उत्सर्जित करते हैं।
अतः ये अभिक्रियाएँ ऊष्माक्षेपी होती हैं।
कैल्सियम व मैग्नीशियम जल से अभिक्रिया कर सतह पर तैरते हैं।Ca + 2H₂O → Ca(OH)₂ + H₂(g)
Mg + 2H₂O → Mg(OH)₂ + H₂(g)13. आयनिक यौगिकों के गुणधर्म —
- भौतिक प्रकृति — धन एवं ऋण आयनों के मध्य आकर्षण बल होने के कारण ये ठोस और कठोर होते हैं। यह भंगुर प्रकृति के भी होते हैं जो दबाव से टुकड़ों में टूट जाते हैं।
- गलनांक व क्वथनांक — अंतर-आयनिक आकर्षण बल को तोड़ने के लिए अधिक ऊष्मा की आवश्यकता होती है, अतः इनके गलनांक व क्वथनांक उच्च होते हैं।
- घुलनशीलता — यह जल में घुलनशील तथा केरोसिन, पेट्रोल में अघुलनशील होते हैं।
- विद्युत चालकता — विद्युत के चालन के लिए आयनों की गतिशीलता आवश्यक होती है। विलयन में विद्युत धारा प्रवाहित करने पर आयन विपरीत इलेक्ट्रोड की ओर गमन करते हैं।
नोट: ठोस अवस्था में आयनों की गति संभव न होने के कारण आयनिक यौगिक ठोस अवस्था में विद्युत का चालन नहीं करते।
खनिज —
पृथ्वी की भू-पर्पटी में प्राकृतिक रूप से पाए जाने वाले तत्वों या यौगिकों को खनिज कहते हैं।
उदाहरण — लोहा, जस्ता, सीसा, एल्युमिनियम संयुक्त रूप में पाए जाते हैं।
अयस्क —
वे खनिज जिनसे कोई विशेष धातु अधिक मात्रा में प्राप्त होती है, अयस्क कहलाते हैं।
नोट — “सभी अयस्क खनिज होते हैं, लेकिन सभी खनिज अयस्क नहीं होते।”
धातुओं का निष्कर्षण —
- कुछ धातुएँ पृथ्वी में मुक्त अवस्था में पाई जाती हैं, तो कुछ अशुद्ध यौगिकों के रूप में।
- सक्रियता श्रेणी में नीचे की धातुएँ जैसे — कॉपर, गोल्ड, सिल्वर — मुक्त अवस्था में पाई जाती हैं।
- सक्रियता श्रेणी में मध्यम धातुएँ जैसे — जिंक, लेड, आयरन — सल्फाइड व कार्बोनेट के रूप में पाई जाती हैं।
- सक्रियता श्रेणी के ऊपर की धातुएँ अधिक प्रतिक्रियाशील होने के कारण कभी भी मुक्त अवस्था में नहीं पाई जातीं।
- सक्रियता वर्ग में आने वाली धातुओं का निष्कर्षण अयस्क से निम्न विधियों द्वारा किया जाता है —
सक्रियता श्रेणी में नीचे स्थित धातुओं का निष्कर्षण —
इनके धातु ऑक्साइड को केवल गर्म करके ही प्राप्त किया जा सकता है।
उदाहरण — सिनाबार (HgS) पारे का अयस्क है। वायु में सिनाबार को गर्म करने पर पारा प्राप्त होता है।
HgO को जब वायु में गर्म किया जाता है-
सक्रियता श्रेणी में मध्यम स्थित धातुओं का निष्कर्षण —
- इस श्रेणी की धातुएँ सल्फाइड व कार्बोनेट के रूप में पाई जाती हैं। धातु को उसके ऑक्साइड से प्राप्त करना अधिक आसान होता है। अतः पहले सल्फाइड व कार्बोनेट को उनके धातु ऑक्साइड में परिवर्तित किया जाता है।
- सल्फाइड अयस्क को भर्जन विधि द्वारा धातु ऑक्साइड में परिवर्तित किया जाता है।
- कार्बोनेट अयस्क को अपघटन विधि द्वारा धातु ऑक्साइड में परिवर्तित किया जाता है।
भर्जन— सल्फाइड अयस्क को वायु की उपस्थिति में अधिक ताप पर गर्म करना।
निस्तापन — कार्बोनेट अयस्क को सीमित वायु अथवा वायु की अनुपस्थिति में सीमित ताप पर गर्म करना।
- धातु ऑक्साइड से धातु प्राप्त करने के लिए कार्बन अपचायक का प्रयोग किया जाता है।
नोट — विस्थापन अभिक्रिया द्वारा भी धातु ऑक्साइड से धातु प्राप्त की जा सकती है।
- इसमें अपचायक के रूप में अत्यधिक प्रतिक्रियाशील धातु का प्रयोग किया जाता है।
उदाहरण — Na, Ca, Al आदि।
ऊष्माक्षेपी अभिक्रिया —
- इस अभिक्रिया का उपयोग रेल की पटरी व मशीनरी पुर्जों की दरारों को जोड़ने के लिए किया जाता है।
सक्रियता श्रेणी में सबसे ऊपर की धातुओं का निष्कर्षण —
- ये धातुएँ अत्यधिक प्रतिक्रियाशील होती हैं।
उदाहरण — Na, Mg, Ca
- इन्हें विद्युत अपघटन विधि द्वारा प्राप्त किया जाता है।
- इन धातुओं को उनके गलित क्लोराइडों के विद्युत अपघटन से प्राप्त किया जाता है।
(कैथोड (—) पर) → धातु का निक्षेपण
(एनोड (+) पर) → क्लोरीन गैस मुक्त
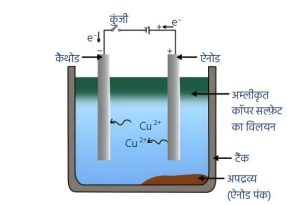
धातुओं का परिष्करण —
- अशुद्ध धातुओं से अपद्रव्य हटाकर पूर्ण रूप से शुद्ध धातु प्राप्त करने की विधि परिष्करण कहलाती है।
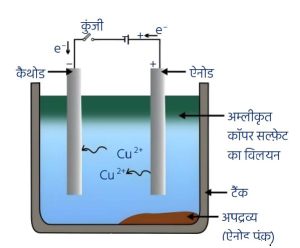
- मुख्य विधि — विद्युत अपघटी परिष्करण (Electrolytic Refining)
- इस विधि द्वारा Cu, Zn, Sn (टिन), Ni (निकल), Ag (चाँदी) तथा Au (सोना) जैसी धातुओं का परिष्करण किया जाता है।
- अशुद्ध धातु को ऐनोड और शुद्ध धातु की पतली पट्टी को कैथोड बनाया जाता है।
- धातु का लवण विलयन विद्युत अपघट्य के रूप में प्रयोग किया जाता है।
- जब विद्युत प्रवाहित की जाती है, तो ऐनोड पर स्थित अशुद्ध धातु विद्युत अपघट्य में घुल जाती है तथा समान मात्रा में शुद्ध धातु कैथोड पर जम जाती है।
- विलेय अशुद्धियाँ विलयन में चली जाती हैं, जबकि अविलेय अशुद्धियाँ ऐनोड की तल पर जम जाती हैं, जिन्हें ऐनोड पंक कहते हैं।
संक्षारण —
- जब कोई धातु किसी अम्ल, आर्द्रता के संपर्क में आती है, तो उस धातु का क्षय / हास हो जाता है। इस प्रक्रिया को संक्षारण कहते हैं।
उदाहरण 1 — खुली वायु में चांदी (Ag) काली हो जाती है क्योंकि चांदी वायु में उपस्थित सल्फर के साथ अभिक्रिया कर चांदी सल्फाइड (Ag₂S) की परत बना लेती है।
उदाहरण 2 — कॉपर (Cu) पर वायु में हरी परत चढ़ जाती है क्योंकि कॉपर वायु में उपस्थित कार्बन डाइऑक्साइड से अभिक्रिया कर कॉपर कार्बोनेट (CuCO₃) बना लेता है।
संक्षारण से बचाव के उपाय —
- पेंट करके, तेल लगाकर, ग्रीस लगाकर।
- क्रोमियम लेपन।
- ऐनोडीकरण।
- जस्ता लेपन — लोहे को जंग से बचाने के लिए उस पर जस्ता (Zn) की पतली परत चढ़ाना जस्ता लेपन कहलाता है।
नोट —
- शुद्ध लोहा अत्यन्त नरम होता है। उसे कठोर बनाने के लिए लोहे में कार्बन (0.05%) मिलाया जाता है।
- स्टेनलेस स्टील (इस्पात) — लोहा + निकल + क्रोमियम → इस पर जंग नहीं लगती।
- मिश्रधातु — दो या दो से अधिक धातुओं के समांगी मिश्रण को मिश्रधातु कहते हैं।
- यदि मिश्रधातु में एक धातु पारा (Hg) हो तो उसे अमलगम कहते हैं।
कुछ मिश्रधातुएँ —
(a) पीतल = तांबा (Cu) + जस्ता (Zn)
(b) कांसा = तांबा (Cu) + टिन (Sn)
(c) सोल्डर = सीसा (Pb) + टिन (Sn)
- इसका गलनांक बहुत कम होता है। इसका उपयोग विद्युत तारों की पिघलन एवं सोल्डरिंग के लिए किया जाता है।
नोट —
- शुद्ध सोने को 24 कैरेट कहते हैं।
- 24 कैरेट का सोना काफी नरम होता है, इससे आभूषण नहीं बनाए जा सकते।
- इसे कठोर बनाने के लिए इसमें चांदी या तांबा मिलाया जाता है।
- आभूषण बनाने के लिए 22 कैरेट सोने का उपयोग किया जाता है।
- 22 कैरेट सोना = 22 भाग शुद्ध सोना + 2 भाग तांबा या चांदी।
बहुचयनात्मक प्रश्न—
- सीसा और टिन की मिश्रधातु को कहते हैं —
(अ) स्टील
(ब) सोल्डर
(स) गन
(द) मेटल
(ब)
लघुत्तरात्मक प्रश्न—
- स्टील में कार्बन का प्रतिशत कितना होता है?
- पीतल मिश्रधातु में कौनसी धातुएँ होती है?
- अमलगम किसे कहते है?
- यशदलेपन क्या होता है?
- थर्मित अभिक्रिया क्या होती है? उदा. सहित लिखिए।
- धातु का विद्युत अपघटनी परिष्करण नामांकित चित्र सहित समझाइये।
- चाँदी पर काले रंग की परत क्यों जम जाती है?
- कौन सी धातु आसानी से संक्षारित नहीं होती है?
- मिश्रधातु क्या होते हैं?
- भर्जन व निस्तापन में अंतर लिखिए।
- गर्म जल का टैंक बनाने में ताँबे का उपयोग होता है परंतु इस्पात (लोहे की मिश्रधातु) का नहीं इसका कारण बताइए।
- धातु को उसके ऑक्साइड से प्राप्त करने के लिए किस रासायनिक प्रक्रम का उपयोग किया जाता है?
लघुत्तरात्मक प्रश्न के हल—
1. स्टील में कार्बन का प्रतिशत 0.05 प्रतिशत होता है।
2. पीतल मिश्रधातु ताँबा (Cu) व जस्ता (Zn) से मिलकर बना होता है।
3. मिश्रधातु में कोई एक धातु यदि पारा हो तो उस मिश्रधातु को अमलगम कहते हैं।उदाहरण – पारा और चाँदी का मिश्रण जो दन्त चिकित्सा में दाँतों को भरने के लिए किया जाता है।
4. लोहे को जंग से बचाने के लिए उस पर जस्ता (Zn) की पतली परत चढ़ाने की प्रक्रिया यशदलेपन कहलाती है।
5. Fe₂O₃ (s) + 2Al (s) → 2Fe (l) + Al₂O₃ (s) + ऊष्मा(आयरन (III) ऑक्साइड)इस अभिक्रिया का उपयोग रेल की पटरी व मशीनों के पुर्जों की दरारों को जोड़ने के लिए किया जाता है।
6. विद्युत अपघटनी परिष्करण —
इस विधि द्वारा Cu, Zn, Sn (टिन), निकल (Ni), चाँदी (Ag), गोल्ड (Au) आदि का परिष्करण किया जाता है।
अशुद्ध धातु को ऐनोड तथा शुद्ध धातु की पतली पत्ती को कैथोड बनाया जाता है।
धातु का लवण विलयन अपघटन के लिए इलेक्ट्रोलाइट के रूप में लिया जाता है।
धारा प्रवाहित करने पर ऐनोड पर स्थित अशुद्ध धातु इलेक्ट्रोलाइट में घुल जाती है, तथा उसी मात्रा में शुद्ध धातु कैथोड पर जम जाती है।
विलेय अशुद्धियाँ विलयन में चली जाती हैं, जबकि अविलेय अशुद्धियाँ ऐनोड तली पर जम जाती हैं, जिसे ऐनोड पंक कहते हैं।
7. खुली वायु में चाँदी काली हो जाती है, क्योंकि चाँदी वायु में उपस्थित सल्फर के साथ अभिक्रिया कर सिल्वर सल्फाइड (Ag₂S) की परत बनाती है। यह परत काले रंग की होती है।
8. सोना तथा प्लेटिनम आसानी से संक्षारित नहीं होते हैं।
9. दो या दो से अधिक धातुओं के समांगी मिश्रण को मिश्रधातु कहते हैं।
1. पीतल (Brass) = ताँबा (Cu) + जस्ता (Zn)
2. कांसा (Bronze) = ताँबा (Cu) + टिन (Sn)
3. सोल्डर (Solder) = सीसा (Pb) + टिन (Sn)
4. इस्पात (Stainless Steel) = लोहा (Fe) + निकल (Ni) + क्रोमियम (Cr)
10. भर्जन एवं निस्तापन में अंतर —
भर्जन निस्तापन 1. इसमें अयस्क को वायु की उपस्थिति में गर्म किया जाता है। इसमें अयस्क को सीमित वायु की उपस्थिति में गर्म किया जाता है। 2. यह प्रायः सल्फाइड अयस्क के लिए प्रयुक्त होता है। यह प्रायः कार्बोनेट अयस्क के लिए प्रयुक्त होता है। 3. इस विधि से अयस्क ऑक्सीकृत हो जाते है। इस विधि से अयस्कों का निर्जलीकरण हो जाता है और व स्पंत की तरह हो जाता है। 4. इसमें निस्तापन से अधिक ताप की आवश्यकता होता है। इसमें भर्जन से कम ताप की आवश्यकता होती है। 5. 2Zn(s) +3O2(g) → 2ZnO(s) + 2SO2↑ CaCO3(s) → CaO(s) +CO2↑
11. कॉपर ठंडे जल, गर्म जल या भाप से क्रिया नहीं करता है, इस्पात भाप से क्रिया करती है।
यदि गर्म पानी के टैंक में इस्पात का प्रयोग किया जाएगा तो लोहा भाप के साथ अभिक्रया करके संक्षारित हो जाएगा।
3Fe + 4H2O ® Fe3O4 + 4H2
12. बहुत कम क्रियाशील धातुओं के ऑक्साइड गर्म करने पर ही पृथक हो जाते हैं।
- मध्यम क्रियाशील धातुओं को उसके ऑक्साइड से प्राप्त करने के लिए उपयुक्त अपचायक का उपयोग किया जाता है। उदाहरण: Zn को कार्बन के साथ गर्म करने पर Zn धातु का अपचयन हो जाता है।
- अति क्रियाशील धातुओं को उसके ऑक्साइड से प्राप्त करने के लिए विद्युत अपघटन (Electrolytic Refining) विधि का प्रयोग किया जाता है।
ZnO(s) + C(s) → Zn(s) + CO(g)
RECENT POSTS
UPSSSC Lekhpal Result 2026 Out – Check PDF & Cutoff
Mission Gyan2026-02-27T18:12:57+05:30February 27, 2026|0 Comments
UPSSSC Lekhpal Result 2026 Released The Uttar Pradesh Subordinate Services Selection Commission (UPSSSC) has officially declared the UPSSSC Lekhpal Result 2026 on its website. Candidates who appeared in the exam can now verify whether they [...]
DSSSB ASO Syllabus 2026: Exam Pattern, Syllabus & Tips for Success
Mission Gyan2026-02-26T18:14:56+05:30February 26, 2026|0 Comments
DSSSB ASO Syllabus & Exam Pattern 2026-Complete Guide The Delhi Subordinate Services Selection Board (DSSSB) has announced the syllabus and exam pattern for the Assistant Section Officer (ASO) 2026 exam. Whether you're a first-time candidate [...]
NCERT Class 6 History Ch 6 Answers – Q&A Format
Mission Gyan2026-02-25T23:46:58+05:30February 25, 2026|0 Comments
NCERT Class 6 History Ch 6 Answers The Beginnings of Indian Civilisation (Question–Answer) These NCERT Class 6 History Ch 6 answers are written in simple question-answer format to help students revise quickly and prepare confidently [...]
RBI Office Attendant Admit Card 2026 Out Today – Direct Download Link @ rbi.org.in
Mission Gyan2026-02-24T21:05:42+05:30February 24, 2026|1 Comment
RBI Office Attendant Admit Card 2026 Download Link Active Now The Reserve Bank of India released the RBI Office Attendant Admit Card 2026 on 23 February 2026 on its official website rbi.org.in. Now candidates can [...]
UPSC 2026 Form Last Date Today — Don’t Miss Your Attempt
Mission Gyan2026-02-24T19:02:31+05:30February 24, 2026|0 Comments
UPSC 2026 Last Date Today (Quick Summary) The UPSC 2026 last date to submit the Civil Services Examination form is today. Thousands of aspirants lose their attempt every year simply because they delay filling the [...]
GATE Response Sheet 2026 PDF Download & Score Check
Mission Gyan2026-02-23T18:41:05+05:30February 23, 2026|0 Comments
GATE Response Sheet 2026 PDF Download & Score Check The GATE Response Sheet 2026 PDF has been released on 22 February 2026 on the GOAPS portal. Candidates can now download their recorded responses, compare them [...]
UPSC CAPF AC 2026 Notification – 349 Posts Apply Online
Mission Gyan2026-02-21T20:28:21+05:30February 21, 2026|0 Comments
UPSC CAPF AC 2026 Notification Released The UPSC CAPF AC 2026 notification has been officially released by the Union Public Service Commission. This examination recruits candidates for the post of Assistant Commandant (Group A Officer) [...]
CMAT 2026 Result OUT Live: Download Scorecard & Cutoff
Mission Gyan2026-02-19T20:57:49+05:30February 19, 2026|1 Comment
CMAT 2026 Result OUT! Check Your Percentile & Download Scorecard Now The National Testing Agency (NTA) has officially released the CMAT 2026 result on 17 February 2026. Candidates who appeared for the exam on 25 [...]
CTET Answer Key 2026 LIVE: Response Sheet & Objection Link
Mission Gyan2026-02-19T20:32:45+05:30February 19, 2026|0 Comments
When Will CTET Answer Key 2026 Release? Check Marks & Direct Link The CTET Answer Key 2026 for the February session is expected soon on the official website ctet.nic.in. Candidates who appeared in Paper I [...]
SSC GD Exam Postponed 2026 — Official Notice
Mission Gyan2026-02-19T20:34:03+05:30February 18, 2026|0 Comments
🚨SSC GD Exam Postponed 2026 — Official Notice The Staff Selection Commission (SSC) has officially postponed the SSC GD Constable CBT Exam 2026. The exam was scheduled from 23 February 2026, but will now be [...]